mise à jour : 31-03-2010
cinet.chim
III. Cinétique des réactions élémentaires
complément
La démonstration qui suit est exactement la même dans le cas de la réaction
réversible bimoléculaire contre monomoléculaire : A + B
⇄ C k0, k1 (r 11)
avec : p = −[ k0
(Be+Ae) + k1] et q = −k0.
On suppose k0 > k1.
Réécrivons l'équation
dE/dt = −[ k0 (Be+Ae) + k1 (Ce+De) ] E + (k1−k0) E2 (51)
ou dE/dt = p E + q E2
en termes de vitesse et d'avancement normalisés :
rnorm = r / rinitial = (dE/dt) / (dE/dt)|t = 0
χ = (E0−E) / E0 d'où E = E0 (1−χ)
rnorm est une grandeur positive, variant de 1 à 0 quand χ varie de 0 à 1.
Il vient :
rnorm = (pE + qE2) / (pE0 + qE02)
rnorm = [pE0(1−χ) + qE02(1−χ)2] / (pE0 + qE02)
et finalement :
rnorm = (1−χ) [1−qE0χ / (p + qE0)]
soit
rnorm = (1−χ) (1−α χ) (a)
avec
α = qE0 / (p + qE0)
Afin de discuter le signe de α, il faut remarquer que si l'écart à l'équilibre E, tel qu'on l'a défini (49), peut être positif (A0>Ae), ou négatif (A0<Ae), E/E0 est nécessairement toujours positif, et (dE/dt)/E0 nécessairement négatif, sinon cela voudrait dire que la réaction s'écarte de l'équilibre. Or :
(dE/dt)|t = 0 / E0 = p + qE0
on a donc
p + qE0 < 0 ∀ E0
q étant négatif également (k0 > k1), le signe de α est donc égal à celui de E0.
Le premier terme de l'équation (a) représente la vitesse normalisée
de l'ordre 1 (courbe en pointillés gris sur la figure). Le deuxième terme
correspond à une droite d'ordonnée à l'origine égale à 1 et de pente −α.
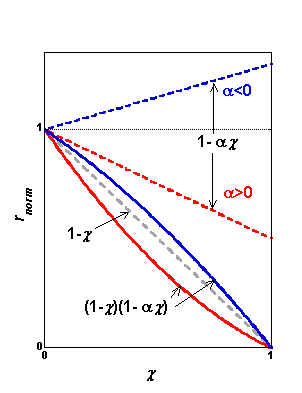
Ainsi, lorsque E0 est positif, (1−χ) est multiplié par un facteur toujours inférieur à 1 et on a (droite et courbe en rouge) :
rnorm < (1−χ)
et, inversement, lorsque E0 est négatif, (1−χ) est multiplié par un facteur toujours supérieur à 1 et on a (droite et courbe en bleu) :
rnorm > (1−χ)
Ce dernier cas correspond à la situation où, bien que
l'équilibre soit en faveur du couple C-D (k0 >
k1), la réaction démarre avec un
excès de C et D et se déroule donc en sens inverse de la flèche principale.